Peptitler, peptit bağları yoluyla çoklu amino asidlerin bağlantısı tarafından oluşturulan bir bileşik sınıfıdır. Canlı organizmalarda her yerde bulunurlar. Şimdiye kadar canlı organizmalarda on binlerce peptit bulundu. Peptitler, çeşitli sistemlerin, organların, dokuların ve hücrelerin ve yaşam aktivitelerinin fonksiyonel aktivitelerinin düzenlenmesinde önemli bir rol oynar ve genellikle fonksiyonel analiz, antikor araştırmaları, ilaç geliştirme ve diğer alanlarda kullanılır. Biyoteknoloji ve peptit sentez teknolojisinin gelişimi ile giderek daha fazla peptit ilacı geliştirilmiş ve klinikte uygulanmıştır.
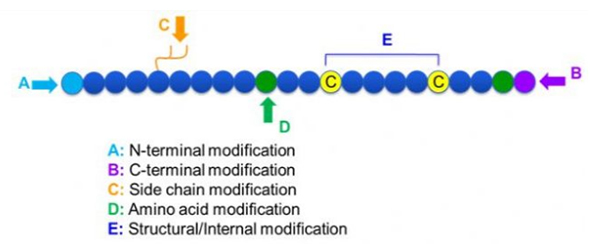
Modifikasyon bölgesine bağlı olarak Post modifikasyonu ve proses modifikasyonu (türetilmiş amino asit modifikasyonu kullanılarak) ve N-terminal modifikasyonu, yan zincir modifikasyonu, amino asit modifikasyonu, iskelet modifikasyonu vb. Ana zincir yapısını veya peptit zincirlerinin yan zincir gruplarını değiştirmek için önemli bir araç olarak, peptit modifikasyonu peptit bileşiklerinin fiziksel ve kimyasal özelliklerini etkili bir şekilde değiştirebilir, su çözünürlüğünü artırabilir, vivo olarak etki süresini değiştirebilir, biyolojik dağılımlarını değiştirebilir, immünojenisiteyi ortadan kaldırabilir, toksik yan etkileri vb.
1. Siklizasyon
Siklik peptitlerin biyomıpta birçok uygulaması vardır ve biyolojik aktiviteli birçok doğal peptit siklik peptitlerdir. Siklik peptitler doğrusal peptitlerden daha sert olma eğiliminde olduğundan, sindirim sistemine son derece dirençlidirler, sindirim sisteminde hayatta kalabilir ve hedef reseptörler için daha güçlü bir afinite sergileyebilirler. Siklizasyon, özellikle büyük yapısal iskeletli peptitler için siklik peptitleri sentezlemenin en doğrudan yoludur. Siklizasyon moduna göre, yan zincir tarafı zincir tipine, terminal - yan zincir tipine, terminal - terminal tipine (uçtan uca tip) bölünebilir.
(1) Sidekin-Sidechain
Yan zincirden yan zincir siklizasyonuna en yaygın tipte, sistein kalıntıları arasındaki disülfür köprülemesidir. Bu siklizasyon, bir çift sistein kalıntısı ile sokulur ve daha sonra disülfür bağları oluşturmak için oksitlenir. Polisiklik sentez, sülfhidril koruma gruplarının seçici olarak çıkarılmasıyla elde edilebilir. Siklizasyon, bir ayrım sonrası çözücüde veya bir ön ayrılma reçinesinde yapılabilir. Reçinelerdeki siklizasyon, solvent siklizasyonundan daha az etkili olabilir, çünkü reçinelerdeki peptitler kolayca siklifiye konformasyonlar oluşturmaz. Başka bir tür yan zincir - yan zincir siklizasyonu, bir aspartik asit veya glutamik asit kalıntısı ile baz amino asit arasında bir amid yapının oluşumudur, bu da yan zincir koruma grubunun reçine veya ayrışmadan sonra polipeptitten seçici olarak çıkarılabilmesi gerekir. Üçüncü tip yan zincir-yan zincir siklizasyonu, difenil eterlerin tirozin veya p-hidroksifenilglisin tarafından oluşumudur. Doğal ürünlerde bu tip siklizasyon sadece mikrobiyal ürünlerde bulunur ve siklizasyon ürünleri genellikle potansiyel tıbbi değere sahiptir. Bu bileşiklerin hazırlanması benzersiz reaksiyon koşulları gerektirir, bu nedenle geleneksel peptitlerin sentezinde sıklıkla kullanılmazlar.

(2) terminalden sidekain
Terminal tarafı zincir siklizasyonu genellikle lizin veya ornitin yan zincirinin amino grubu ile C-terminalini veya aspartik asit veya glutamik asit yan zinciri ile N-terminalini içerir. Diğer polipeptit siklizasyonu, terminal C ile serin veya treonin yan zincirleri arasında eter bağları oluşturularak yapılır.
(3) Terminal veya kafa kafaya tip
Zincir polipeptitleri ya bir çözücü içinde döngüsün veya yan zincir siklasyonu ile bir reçineye sabitlenebilir. Peptitlerin oligomerizasyonunu önlemek için solvent merkezileşmesinde düşük peptit konsantrasyonları kullanılmalıdır. Kafa-kuyruk sentetik halka polipeptidinin verimi, zincir polipeptidinin dizisine bağlıdır. Bu nedenle, siklik peptitleri büyük ölçekte hazırlamadan önce, önce en iyi sonuçlarla diziyi bulmak için olası zincirlenmiş kurşun peptitlerden oluşan bir kütüphane oluşturulmalıdır.
2. N-metilasyonu
N-metilasyonu başlangıçta doğal peptitlerde meydana gelir ve hidrojen bağlarının oluşumunu önlemek için peptit sentezine sokulur, böylece peptitleri biyodegradasyon ve klerens için daha dirençli hale getirir. N-metillenmiş amino asit türevleri kullanılarak peptitlerin sentezi en önemli yöntemdir. Ek olarak, metanol ile N- (2-nitrobenzen sülfonil klorür) polipeptit-rezin ara maddelerinin mitsunobu reaksiyonu da kullanılabilir. Bu yöntem, N-metillenmiş amino asitler içeren siklik peptit kütüphaneleri hazırlamak için kullanılmıştır.
3. Fosforilasyon
Fosforilasyon, doğada en yaygın translasyon sonrası modifikasyonlardan biridir. İnsan hücrelerinde, proteinlerin% 30'undan fazlası fosforile edilir. Fosforilasyon, özellikle geri dönüşümlü fosforilasyon, sinyal transdüksiyonu, gen ekspresyonu, hücre döngüsü ve hücre iskeleti regülasyonu ve apoptoz gibi birçok hücresel sürecin kontrol edilmesinde önemli bir rol oynar.
Fosforilasyon çeşitli amino asit kalıntılarında gözlemlenebilir, ancak en yaygın fosforilasyon hedefleri serin, treonin ve tirozin kalıntılarıdır. Fosfotirozin, fosfotreonin ve fosfoserin türevleri, sentez sırasında peptitlere sokulabilir veya peptit sentezinden sonra oluşabilir. Seçici fosforilasyon, koruyucu grupları seçici olarak uzaklaştıran serin, treonin ve tirozin kalıntıları kullanılarak elde edilebilir. Bazı fosforilasyon reaktifleri, modifikasyon ile polipeptide fosforik asit gruplarını da ekleyebilir. Son yıllarda, lizin bölgesine özgü fosforilasyon, kimyasal olarak seçici bir Staudinger-fosfit reaksiyonu kullanılarak gerçekleştirilmiştir (Şekil 3).

4 MyRistoilasyon ve Palmitoilasyon
N-terminalinin yağ asitleri ile asilasyonu, peptitlerin veya proteinlerin hücre zarlarına bağlanmasını sağlar. N-terminal üzerindeki miridamoillenmiş sekans, SRC aile protein kinazlarının ve ters transkriptaz GAQ proteinlerinin hücre zarlarına bağlanmayı hedeflemesini sağlar. MyRistik asit, standart birleştirme reaksiyonları kullanılarak reçine-polipeptidin N-terminaline bağlandı ve sonuçta ortaya çıkan lipopeptid, standart koşullar altında ayrılabilir ve RP-HPLC ile saflaştırılabilir.
5. Glikosilasyon
Vankomisin ve teikolanin gibi glikopeptitler, ilaca dirençli bakteriyel enfeksiyonların tedavisi için önemli antibiyotiklerdir ve diğer glikopeptitler genellikle bağışıklık sistemini uyarmak için kullanılır. Ek olarak, birçok mikrobiyal antijen glikosile olduğundan, enfeksiyonun terapötik etkisini iyileştirmek için glikopeptitleri incelemek büyük önem taşımaktadır. Öte yandan, tümör hücrelerinin hücre zarındaki proteinlerin anormal glikosilasyon sergilediği, bu da glikopeptitlerin kanser ve tümör bağışıklık savunma araştırmalarında önemli bir rol oynamasını sağladığı bulunmuştur. Glikopeptitler FMOC/T-BU yöntemi ile hazırlanır. Treonin ve serin gibi glikosillenmiş tortular, genellikle glikosillenmiş amino asitleri korumak için pentafluorofenol ester aktive edilmiş FMOC'lerle polipeptitlere sokulur.
6. İzopren
İzopentadienilasyon, C-terminalinin yakınındaki yan zincirdeki sistein kalıntılarında meydana gelir. Protein izopren hücre zarı afinitesini iyileştirebilir ve protein-protein etkileşimini oluşturabilir. İzopentadienlenmiş proteinler arasında tirozin fosfataz, küçük gtaz, kokaperon molekülleri, nükleer lamina ve sentromerik bağlanma proteinleri bulunur. İzopren polipeptitler, reçineler üzerinde izopren kullanılarak veya sistein türevleri eklenerek hazırlanabilir.
7. Polietilen glikol (PEG) modifikasyonu
PEG modifikasyonu, protein hidrolitik stabilitesini, biyodistribütürü ve peptit çözünürlüğünü arttırmak için kullanılabilir. PEG zincirlerinin peptitlere sokulması, farmakolojik özelliklerini geliştirebilir ve ayrıca proteolitik enzimler tarafından peptitlerin hidrolizini inhibe edebilir. PEG peptitleri glomerüler kılcal kesitten sıradan peptitlerden daha kolay geçer ve böbrek klerensini büyük ölçüde azaltır. PEG peptitlerinin in vivo genişletilmiş aktif yarılanma ömrü nedeniyle, normal tedavi seviyesi daha düşük dozlar ve daha az sık peptit ilaçları ile korunabilir. Bununla birlikte, PEG modifikasyonunun da olumsuz etkileri vardır. Büyük miktarlarda PEG, enzimin peptidi parçalamasını önler ve ayrıca peptitin hedef reseptöre bağlanmasını azaltır. Ancak PEG peptitlerinin düşük afinitesi genellikle daha uzun farmakokinetik yarılanma ömrü ile dengelenir ve vücutta daha uzun süre bulunarak, PEG peptitleri hedef dokulara emilme olasılığı daha yüksektir. Bu nedenle, PEG polimer spesifikasyonları optimal sonuçlar için optimize edilmelidir. Öte yandan, PEG peptitleri, böbrek klerensinin azalması nedeniyle karaciğerde birikir ve makromoleküler sendromla sonuçlanır. Bu nedenle, ilaç testi için peptitler kullanıldığında PEG modifikasyonlarının daha dikkatli bir şekilde tasarlanması gerekir.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, N-hidroksicinimid -nhs, akrilat-ch2CH2COOH, aldehit -cho (propional-Ald, butyald gibi), akrilik baz (-acrilat-acrl), azido-azid, biyotinil-biyotin, akravat, alrezcein, glutyl-biyotin, aletin, glutyil-biyotin, alrezcein, glutyl-dut, alrezcein, glutyl-dut, alrezcein, glutyl-biyotin, alrezcein, glutyl-biyotin, alrezcein, glutyl-biyotin, aletin, alrezcein P -Toluenesulfonat -ots, süksinimit süksinat, vb. Karboksilik asitli PEG türevleri N -terminal aminlere veya lizin yan zincirlerine bağlanabilir. Amino ile aktifleştirilen PEG aspartik asit veya glutamik asit yan zincirlerine bağlanabilir. Mal-aktifleştirilen PEG, tamamen korumalı sistein yan zincirlerinin Mercaptan'a konjüge edilebilir [11]. PEG değiştiriciler genellikle aşağıdaki gibi sınıflandırılır (Not: MPEG Methoxy-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Düz zincirli PEG değiştirici
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) İki işlevli PEG değiştirici
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, Mal-Peg-NHS
(3) dallanma PEG değiştirici
(MPEG) 2-NHS, (MPEG) 2-Ald, (MPEG) 2-NH2, (MPEG) 2-Mal
8. Biyotinizasyon
Biyotin avidin veya streptavidin ile güçlü bir şekilde bağlanabilir ve bağlanma mukavemeti kovalent bağa bile yakındır. Biyotin etiketli peptitler, immünoanaliz, histositokimya ve floresan bazlı akış sitometrisinde yaygın olarak kullanılır. Etiketli antibiyotin antikorları, biyotinile peptitleri bağlamak için de kullanılabilir. Biyotin etiketleri genellikle lizin yan zincirine veya N terminaline bağlanır. 6-aminokaproik asit genellikle peptitler ve biyotin arasında bir bağ olarak kullanılır. Bağ, substrata bağlanmada esnektir ve sterik engel varlığında daha iyi bağlanır.
9. Floresan etiketleme
Floresan etiketleme, canlı hücrelerdeki polipeptitleri izlemek ve enzimleri ve etki mekanizmalarını incelemek için kullanılabilir. Triptofan (TRP) floresandır, bu nedenle içsel etiketleme için kullanılabilir. Triptofanın emisyon spektrumu periferik ortama bağlıdır ve peptit yapısını ve reseptör bağlanmasını tespit etmek için yararlı olan bir özellik olan azalan solvent polaritesi ile azalır. Triptofan floresan, kullanımını sınırlayabilen protonlanmış aspartik asit ve glutamik asit ile söndürülebilir. Dansil Klorür Grubu (Dansil) bir amino grubuna bağlandığında yüksek oranda floresandır ve genellikle amino asitler veya proteinler için bir floresan etiketi olarak kullanılır.
Floresan rezonans enerji dönüşümü (FRET) enzim çalışmaları için yararlıdır. FRET uygulandığında, substrat polipeptid genellikle bir floresan etiketleme grubu ve bir floresan arası bir grup içerir. Etiketli floresan grupları, foton olmayan enerji transferi yoluyla söndürücü tarafından söndürülür. Peptit söz konusu enzimden ayrıldığında, etiketleme grubu floresan yayar.
10. Kafes polipeptidleri
Kafes peptitleri, peptidi reseptöre bağlanmadan koruyan optik olarak çıkarılabilir koruyucu gruplara sahiptir. UV radyasyonuna maruz kaldığında, peptit aktive edilir ve reseptöre afinitesini geri yükler. Bu optik aktivasyon zamana, genliğe veya konuma göre kontrol edilebildiğinden, kafes peptitleri hücrelerde meydana gelen reaksiyonları incelemek için kullanılabilir. Kafes polipeptitleri için en sık kullanılan koruyucu gruplar, 2-nitrobenzil grupları ve bunların türevleridir, bu da koruyucu amino asit türevleri yoluyla peptit sentezine sokulabilir. Geliştirilen amino asit türevleri lizin, sistein, serin ve tirozindir. Bununla birlikte, aspartat ve glutamat türevleri, peptit sentezi ve ayrışma sırasında siklizasyona duyarlılığı nedeniyle yaygın olarak kullanılmamaktadır.
11. Poliantijenik peptit (MAP)
Kısa peptitler genellikle bağışık değildir ve antikor üretmek için taşıyıcı proteinlere bağlanmalıdır. Poliantijenik peptit (MAP), lizin çekirdeğine bağlı, spesifik olarak yüksek potens immünojenleri eksprese edebilen ve peptit taşıyıcı protein bir dağıtımları hazırlamak için kullanılabilen çoklu özdeş peptitlerden oluşur. MAP polipeptitleri, MAP reçinesi üzerindeki katı faz sentezi ile sentezlenebilir. Bununla birlikte, eksik kuplaj bazı dallarda eksik veya kesilmiş peptit zincirleri ile sonuçlanır ve bu nedenle orijinal harita polipeptidinin özelliklerini sergilemez. Alternatif olarak, peptitler ayrı olarak hazırlanabilir ve saflaştırılabilir ve daha sonra haritaya bağlanabilir. Peptit çekirdeğine bağlı peptit sekansı iyi tanımlanmıştır ve kütle spektrometresi ile kolayca karakterize edilir.
Çözüm
Peptit modifikasyonu, peptitlerin tasarlanmasının önemli bir yoludur. Kimyasal olarak modifiye edilmiş peptitler sadece yüksek biyolojik aktiviteyi korumakla kalmaz, aynı zamanda immünojenisite ve toksisitenin dezavantajlarından da etkili bir şekilde kaçınır. Aynı zamanda, kimyasal modifikasyon peptitleri bazı yeni mükemmel özelliklere sahip olabilir. Son yıllarda, polipeptitlerin post-modifikasyonu için C-H aktivasyonu yöntemi hızla geliştirilmiştir ve birçok önemli sonuç elde edilmiştir.
Gönderme: 2025-07-03
